As the first US FDA (Food and Drug Administration)-approved monoclonal antibody drug for the treatment of B-cell lymphomas and later on for the treatment of autoimmune diseases, Rituximab has been widely sold under the trade name of Rituxan○R ever since 1997 with an average sales volume over 2 billion dollars each year in the U.S. However, the recognition mechanism between Rituximab and its target CD20, an antigen expressed on the surface of mature B-cells, remained unclear. Now, an important step toward decoding the long-standing problem is achieved by scientists at the CAS Shanghai Institutes for Biological Sciences (SIBS) and their collaborators from the Second Military Medical University.
With the help of structural biology and biological chemistry, a group of researchers headed by Prof. DING Jianping with the Key Laboratory of Molecular Biology, SIBS, successfully figured out the molecular basis for the identification of CD20 by Rituximab, providing valuable information for the improvement of antibody drugs with better specificity and higher affinity.
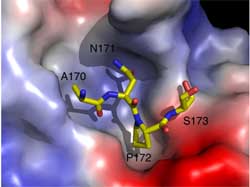
To understand the molecular mechanism of recognition of human CD20 by Rituximab, researchers synthesized a peptide comprising the CD20 epitope to mimic its extracellular region under natural circumstances, and analyzed the crystal structure of Rituximab Fab fragment in complex with the peptide. The combining site of the Fab, they found, consists of four complementarity determining regions (CDRs) that form a large, deep pocket to accommodate the epitope peptide. Meanwhile, the bound peptide assumes a unique cyclic conformation that is constrained by a disulfide bond and a rigid proline residue. The 170ANPS173 motif of CD20 is deeply embedded into the pocket on the antibody surface and plays an essential role in the recognition and binding of Rituximab.
Experts said that the antigen-antibody interactions involve both hydrogen bonds and van der Waals contacts, and display a high degree of structural and chemical complementarity. Further studies showed that changes of the residues on CDR loops of the Rituximab Fab that could generate more favorable interactions with the residues of the epitope of CD20 might increase its binding affinity and specificity with CD20. Patent has been applied in this regard for the development of improved Rituximab drugs.
The result was published online by the
Journal of Biological Chemistry on March 29, 2007.





