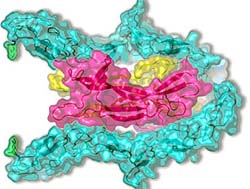
CAS biophysicists have made new discoveries about a nerve-nutritional factor. Under the guidance of Prof. JIANG Tao with the CAS Institute of Biophysics (IBP), Dr. GONG Yong and Dr. CAO Peng revealed crystal structure of a symmetrical complex made up of the neurotrophin-3 and p74NTR, revealing the mode of their interaction and their structural basis. The work was published on-line by the journal
Nature on 2 July.
Neurotrophins (NTs) are important regulators for the survival, differentiation and maintenance of different peripheral and central neurons. NTs bind to two distinct classes of glycosylated receptor: the p75 neurotrophin receptor (p75NTR) and tyrosine kinase receptors (Trks). Whereas p75NTR binds to all NTs, the Trk subtypes are specific for each NT. The question of whether NTs stimulate p75NTR by inducing receptor homodimerization is still under debate.
Using an X-ray crystallography, the IBP researchers revealed the 3D crystal structure of NT-3 complexed to the ectodomain of its receptor, p75NTR, on 2.6-A resolution. Their bio-chemical analyses show the specific mode of the two's binding, making clear the underlying mechanism which governs the interaction. It provides a solid foundation on the bio-molecular structure in search of new drugs against nervous lesion. Experts say that results offer a model of NTs-p75NTR recognition and signal generation, as well as insights into coordination between p75NTR and Trks.







